Сегодня аббревиатуру pH можно увидеть не только на уроках химии, но и на упаковках товаров бытовой химии, личной гигиены, косметики и прочих. Что такое pH мы объясним буквально на пальцах в нашей статье, а также расскажем о методах его измерения.
Показатель Ph еще называют водородным, по значению которого судят, каким является раствор — кислым, нейтральным или щелочным. Измерить показатель pH можно с помощью индикаторов — веществ, изменяющих цвет в разной среде.
- Шкала pH — показатель кислого, нейтрального или щелочного раствора
- От чего зависит уровень кислотности
- Измерение pH
- Ионизация и сила кислоты
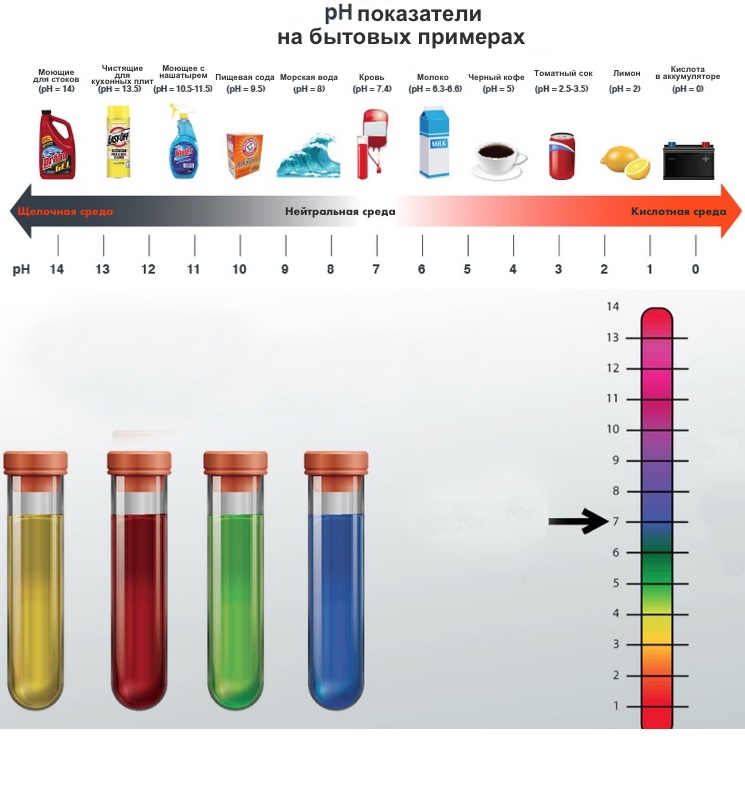
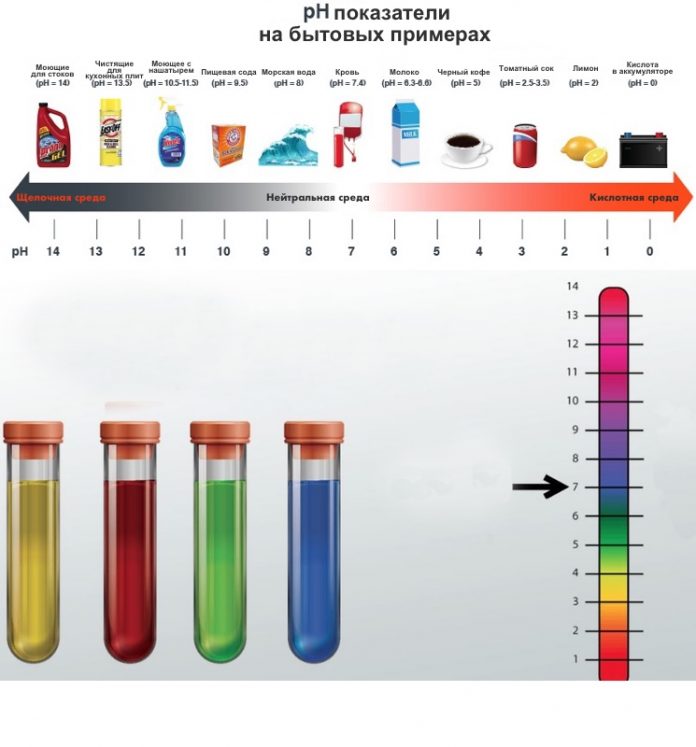
Шкала pH — показатель кислого, нейтрального или щелочного раствора
Водородный показатель pH (сокращенное от английского «power of hydrogen») позволяет судить о том, каким является раствор — кислым, нейтральным или щелочным.
Обычный интервал значений pH от 1 до 14. Значение pH определяется концентрацией ионов водорода в растворе. Нейтральные (ни кислые, ни щелочные) растворы характеризуются значением pH около 7. Чем ниже значения pH, тем сильнее кислота. Уксусная кислота, считающаяся слабой, имеет pH около 5. Сильные кислоты имеют значение pH, близкое к нулю, или даже отрицательное значение pH.
Видео для более углубленного изучения pH. Необходимы базовые знания по химии.
Щелочные растворы имеют pH выше 7; pH растворов сильных щелочей, таких как гидроксид натрия, NaOH, равен 14, а может быть и больше.
От чего зависит уровень кислотности
При добавлении кусочков цинка к соляной кислоте металл быстро реагирует и растворяется. Однако даже концентрированная лимонная кислота не оказывает никакого действия на цинк. Органические кислоты, такие как лимонная и уксусная, являются слабыми кислотами. Неорганические, такие как серная, соляная, относятся к сильным кислотам.
Растворы сильных кислот состоят только из ионов водорода и ионов кислотного остатка. Растворы более слабых кислот содержат также и неионизируемые молекулы.
Измерение pH
Простейший способ измерения pH среды — использование индикатора. Индикаторы — это вещества, принимающие различную окраску при разных значениях pH.
Лакмус, например, — это индикатор растительного происхождения, который краснеет в кислой среде и и синеет в щелочной. С помощью лакмуса или лакмусовой бумажки можно узнать, кислая среда или щелочная. Другие индикаторы меняют цвет в более узких интервалах pH.
Метиловый оранжевый, например, изменяет цвет в интервале pH 3-4,5. Использование комбинаций индикаторов позволяет довольно точно определить водородный показатель.
Более точно измерить pH раствора можно прибором, называемым pH-метром. В нем используется специальный электрод, регистрирующий концентрацию ионов водорода, а значения выводятся на шкалу.
Незначительное изменение pH влияет на живущие в воде организмы. Для измерения pH воды биологи используют электронные pH-метры, измеряющие водородный показатель среды с точностью до 0,1.
Ионизация и сила кислоты
Значение pH сильной кислоты показывает, что все ее молекулы диссоциированы (расщеплены) на ионы водорода и ионы кислородного остатка. Слабые кислоты ионизированы только частично, и только небольшая часть их молекул диссоциирована с образованием ионов водорода. В итоге их растворы являются менее кислыми, чем растворы сильных кислот. Аналогично слабые основания дают лишь небольшое количество гидроксид-ионов.