Не будем загонять себя в строгие рамки с самого начала и опишем термин максимально просто: процессом окисления органических веществ (органики; это, например, белки, жиры и углеводы) называется реакция, в результате которой увеличивается объём кислорода (O2) и уменьшается объём водорода (H2).
Органические вещества – это различные химические соединения, у которых в состав входит углерод (С). Исключение составляют угольная кислота (H2CO3), карбиды (например, карборунд SiC, цементит Fe3C), карбонаты (к примеру, кальцит CaCO3, магнезит MgCO3), оксиды углерода, цианиды (такие как KCN, AgCN). Органические вещества вступают во взаимодействие с наиболее известным окислителем, кислородом O2, при этом образуя воду H2O и углекислый газ CO2.
- Процесс окисления органических веществ
- Способность органических веществ к окислению
- Окисление органических веществ в клетке организмов растений, животных и человека
- Роль окисления органики в промышленности
- Принципы составления уравнений в органической химии
- Реакции окисления органических веществ и их конечные продукты образования

Процесс окисления органических веществ
Если рассуждать логически, то раз процесс полного окисления – это горение, то процесс неполного – это окисление органики, потому что при таком воздействии происходит не воспламенение вещества, а лишь его нагревание (сопровождающееся выделением определённого количества энергии в виде АТФ – аденозинтрифосфата – и теплоты Q).
Реакция органического окисления не слишком замысловата, поэтому её начинают разбирать ещё в начале курса химии, и ученики быстро усваивают информацию, если, конечно, прикладывают хоть какие-нибудь усилия. Мы уже узнали, что это за процесс, и теперь предстоит вникнуть в саму суть дела. Итак, каким образом протекает реакция и что из себя представляет?
Окисление органического вещества – это своего рода переход, превращение одного класса соединений в другой. Например, весь процесс начинается с окисления насыщенного углеводорода и его превращения в ненасыщенный, затем полученное вещество окисляется до образования спирта; спирт, в свою очередь, образует альдегид, из альдегида «вытекает» карбоновая кислота. В результате всей процедуры мы получаем углекислый газ (при записи уравнения не забываем поставить соответствующую стрелочку ↑) и воду.
Это окислительно-восстановительная реакция, причём в большинстве случаев органическое вещество проявляет восстановительные свойства, а само окисляется. Для каждого задействованного элемента определена своя классификация – он либо восстановитель, либо окислитель, и мы даём название, исходя из результата ОВР.
Способность органических веществ к окислению
Теперь мы знаем, что в процессе ОВР (окислительно-восстановительной реакции) принимают участие окислитель, забирающий электроны и имеющий отрицательный заряд, и восстановитель, отдающий электроны и имеющий положительный заряд. Однако не каждое вещество может вступать в процесс, который мы с вами рассматриваем. Чтобы было проще понять, рассмотрим по пунктам.
Соединения не окисляются:
- Алканы – по-другому называются парафины или насыщенные углеводороды (например, метан, имеющий формулу CH4);
- Арены – это ароматические органические соединения. Среди них не окисляется бензол (по идее эту реакцию можно провести, но путём нескольких долгих шагов; самостоятельно окисление бензола не произвести);
- Третичные спирты – это спирт, у которого гидроксогруппа OH связывается с третичным атомом углерода;
- Фенол – по-другому называется карболовая кислота и в химии записывается в виде формулы C6H5OH.
Примеры органических веществ, способных к окислению:
- Алкены;
- Алкины (в результате мы проследим образование альдегида, карбоновой кислоты или кетона);
- Алкадиены (образуются либо многоатомные спирты, либо кислоты);
- Циклоалканы (при наличии катализатора образуется дикарбоновая кислота);
- Арены (до бензойной кислоты могут окисляться любые вещества, которые имеют схожее с бензолом строение, то есть его гомологи);
- Первичные, вторичные спирты;
- Альдегиды (имеют способность окисляться то карбонов);
- Амины (при окислении происходит образование одного или нескольких соединений с нитрогруппойNO2).
Окисление органических веществ в клетке организмов растений, животных и человека
Это наиболее важный вопрос не только для тех людей, которые интересуются химией. Подобного рода знания должен иметь каждый, чтобы сформировать верное представление о разных процессах в природе, о ценности каких-либо веществ в мире и даже о самом себе – человеке.
Из курсов школьной биологии вы, наверное, уже в курсе, что окисление органики играет не последнюю биологическую роль в организме человека. В результате окислительно-восстановительных реакций происходит расщепление БЖУ (белков, жиров, углеводов): в клетках выделяется теплота, АТФ и другие носители энергии, и наше тело всегда обеспечено достаточным запасом для выполнения действий и нормального функционирования систем органов.
Протекание данного процесса способствует поддержанию постоянной температуры тела в организме не только человека, но и любого другого теплокровного животного, а также помогает регулировать постоянство внутренней среды (это называется гомеостаз), обмен веществ, обеспечивает качественную работу органоидов клетки, органов, а также выполняет ещё множество необходимых функций.
При фотосинтезе растениями поглощается вредный углекислый газ и образуется кислород, необходимый для дыхания.
Биологическое окисление органических веществ может протекать исключительно с использованием различных переносчиков электронов и ферментов (без них данный процесс длился бы невероятно долго).
Роль окисления органики в промышленности
Если говорить о роли окисления органики в промышленности, то это явление применяется в нефтехимическом синтезе, в работе уксуснокислых бактерий (при неполном органическом окислении они образовывают ряд новых веществ), а в некоторых случаях с органикой возможно также производство взрывоопасных веществ.
Принципы составления уравнений в органической химии
В химии не обходится без составления уравнения – это своего рода язык данной науки, на котором могут говорить все учёные планеты независимо от национальности и понимать друг друга.
Однако наибольшие трудности вызывает составление уравнений, когда предстоит изучение органической химии.
Для разборки этой темы требуется очень большой промежуток времени, поэтому здесь подобран лишь краткий алгоритм действий для решения цепочки уравнений с некоторыми пояснениями:
- Во-первых, мы сразу смотрим, сколько реакций протекает в данном процессе, нумеруем их. Также определяем классы, названия веществ исходных и веществ, которые в итоге образуются;
- Во-вторых, необходимо поочерёдно выписать все уравнения и узнать тип их реакций (соединение, разложение, обмен, замещение) и условия.
- После этого можно составить электронный балансы, а также не забываем расставлять коэффициенты.
Реакции окисления органических веществ и их конечные продукты образования
В качестве наглядных примеров далее рассмотрим окислительно-восстановительные реакции самых распространенных классов органических соединений
Окисление бензола
Даже в самых агрессивных условиях бензол не подвержен окислению. Однако гомологи бензола способны окисляться под воздействием раствора перманганата калия в нейтральной среде до образования бензоата калия.

Если сменить нейтральную среду на кислотную, то гомологи бензола способны окисляться перманганатом или дихроматом калия с итоговым образованием бензойной кислоты.
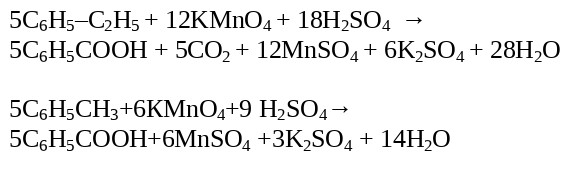
Формула образование бензойной кислоты

Окисление алкенов
При окислении алкенов неорганическим окислителями конечными продуктами являются так называемые двухатомные спирты — гликогены. Восстановителями в данных реакциях являются атомы углерода.
Наглядный тому пример является химическая реакция раствора перманганата калия в связи с слабой щелочной средой.
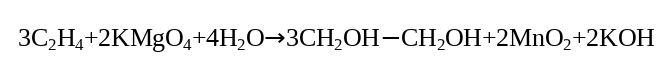
Агрессивные условия окисления приводят тому, что углеродная цепь разрушается по двойной связи с итоговыми продуктами образования в виде двух кислот. Причем если среда с повышенным содержанием щелочи образуется две соли. Также продуктами вследствие распада цепи углерода может образовываться кислота и диоксид углерода, а вот в условиях сильной щелочной среды — продуктами окислительной реакции выступают соли карбоната.

Алкены способны окисляться при погружении в кислотную среду дихромата калия по аналогичной схеме приведенной в первых двух примерах.
Окисление алкинов
В отличие от алкенов, алкины окисляются в более агрессивной среде. Разрушение углеродной цепи происходит по тройной связи. Общим свойством с алкенами являются их восстановители в лице атомов углерода.
Продуктами реакции на выходе являются диоксид углерода и кислоты. Помещенный перманганат калия в кислотную среду будет являться окислителем.
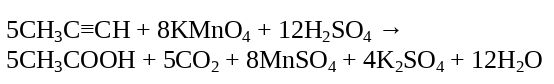
Продуктами окисления ацетилена, в случае его погружения в нейтральную среду с перманганатом калия, является оксалат калия.

При смене нейтральной среды на кислотную реакция окисления протекает до образования углекислого газа или щавелевой кислоты.
Окисления альдегидов
Альдегиды легко подвержены окислению благодаря их свойствам быть сильными восстановителями. В качестве окислителей для альдегидов можно выделить как и в предыдущих вариантах перманганат калия с дихроматом калия, а также преимущественно свойственных для альдегидов раствор гидроксиддиамина серебра — [Ag(NH3)2]OH и гидроксид меди — Cu(OH)2. Важным условием для протекания реакции окисления альдегидов является влияние температуры.
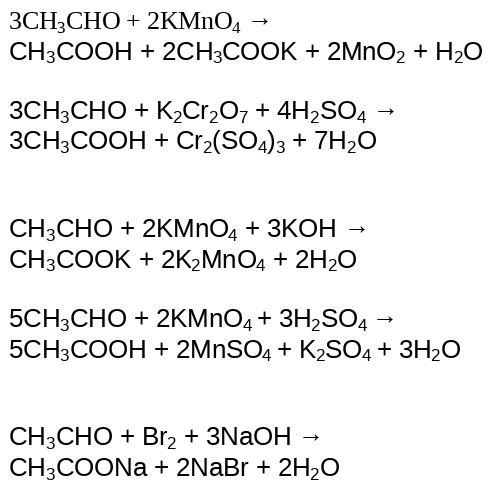
На видео можно видеть как определяют присутствие альдегидов в реакции с гидроксидом меди.
Альдегиды способны окисляться до карбоновых кислот под влиянием гидроксиддиамина серебра в виде раствора с выделением солей аммония. Такая реакция получила название «серебряного зеркала».
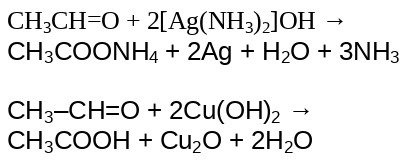
Далее на видео продемонстрирована интересную реакцию, которая носит название «серебряное зеркало». Этот опыт протекает во взаимодействии глюкозы, которая является также альдегидом, с раствором аммиаката серебра.
Окисление спиртов
Продукт окисления спиртов зависит от типа атома углерода с которым связана группа OH спирта. Если группа связана первичным атомом углерода, то продуктом окисления будут альдегиды. В случае если OH группа у спирта связана со вторичным атомом углерода, то продуктом окисления являются кетоны.
Альдегиды, в свою очередь образовавшиеся при окислении спиртов, далее могут окисляться до образования кислот. Это достигается путем окисления первичных спиртов дихроматом калия в кислотной среде при кипении альдегида, которые в свою очередь при испарении не успевают окисляться.
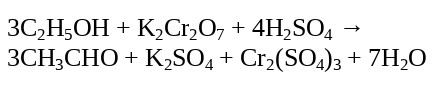
При условии избыточного присутствия таких окислителей, как перманганат калия (KMnO4) и дихромат калия (K2Cr2O7) практически в любых условиях первичные спирты способны окисляться с выделением карбоновых кислот, в вторичные спирты в свою очередь — кетонов, примеры реакций которых с продуктами образования рассмотрим ниже.

Этиленгликоль или так называемый двухатомный спирт в зависимости от среды может окисляться с образованием таких продуктов как щавелевая кислота или оксалата калия. Если этиленгликоль находится в растворе перманганата калия с добавлением кислоты, образуется щавелевая кислота, в случае если двухатомный спирт в этом же растворе перманганата калия либо дихромата калия, но при этом в нейтральной среде, то образуется оксалат калия. Рассмотрим эти реакции.
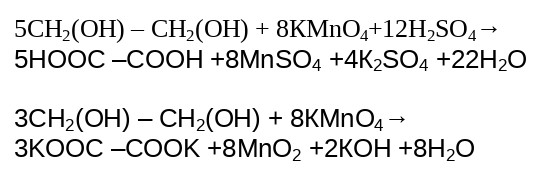
Мы выяснили всё, что необходимо понимать на первых порах и даже начали разбирать такую нелёгкую тему как решение и составление уравнений. В заключение можно только сказать, что сбалансированная практика и частые занятия помогут быстрее закрепить пройденный материал и научиться решать задачи.




УРА! ДО МЕНЯ ДОШЛО, реально огромное спасибо за статью, теперь понимаю это все, в школе непонятно объяснили, а здесь все наглядно, можно еще про ОВР статью с неорганикой?