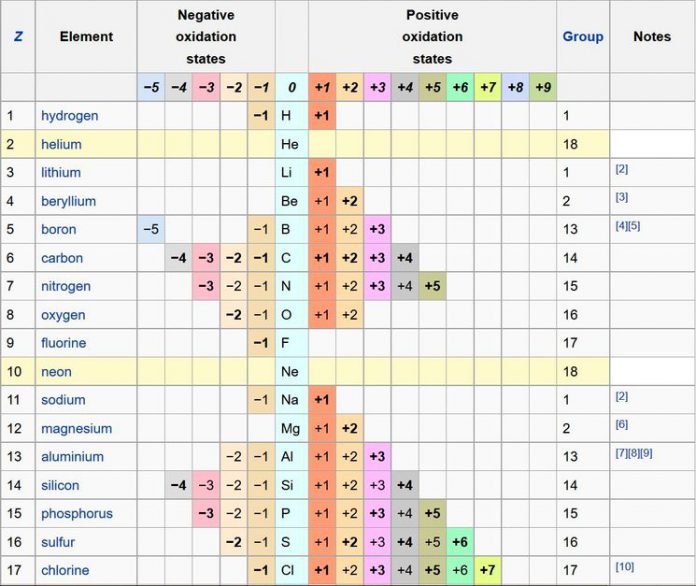
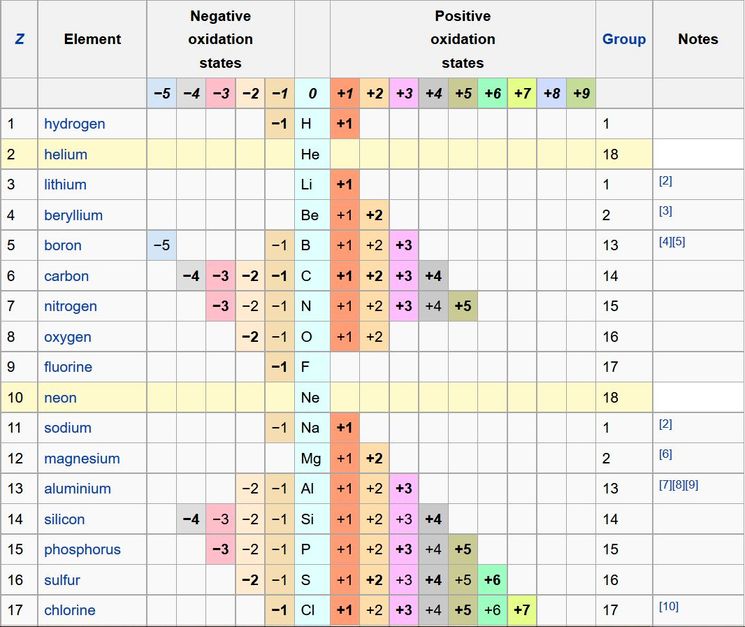
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип. Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе — заряду иона.
Данный список степеней окисления показывает все известные степени окисления химических элементов периодической таблицы Менделеева. Список основан на таблице Гринвуда со всеми дополнениями. В строках, которые выделены цветом, вписаны инертные газы степень окисления которых равна нулю.
| 1 | −1 | H | +1 | ||||||||||
| 2 | He | ||||||||||||
| 3 | Li | +1 | |||||||||||
| 4 | -3 | Be | +1 | +2 | |||||||||
| 5 | −1 | B | +1 | +2 | +3 | ||||||||
| 6 | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||
| 7 | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | ||||
| 8 | −2 | −1 | O | +1 | +2 | ||||||||
| 9 | −1 | F | +1 | ||||||||||
| 10 | Ne | ||||||||||||
| 11 | −1 | Na | +1 | ||||||||||
| 12 | Mg | +1 | +2 | ||||||||||
| 13 | Al | +3 | |||||||||||
| 14 | −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | ||||
| 15 | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||
| 16 | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 17 | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| 18 | Ar | ||||||||||||
| 19 | K | +1 | |||||||||||
| 20 | Ca | +2 | |||||||||||
| 21 | Sc | +1 | +2 | +3 | |||||||||
| 22 | −1 | Ti | +2 | +3 | +4 | ||||||||
| 23 | −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||
| 24 | −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 25 | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||
| 26 | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 27 | −1 | Co | +1 | +2 | +3 | +4 | +5 | ||||||
| 28 | −1 | Ni | +1 | +2 | +3 | +4 | |||||||
| 29 | Cu | +1 | +2 | +3 | +4 | ||||||||
| 30 | Zn | +2 | |||||||||||
| 31 | Ga | +1 | +2 | +3 | |||||||||
| 32 | −4 | Ge | +1 | +2 | +3 | +4 | |||||||
| 33 | −3 | As | +2 | +3 | +5 | ||||||||
| 34 | −2 | Se | +2 | +4 | +6 | ||||||||
| 35 | −1 | Br | +1 | +3 | +4 | +5 | +7 | ||||||
| 36 | Kr | +2 | |||||||||||
| 37 | Rb | +1 | |||||||||||
| 38 | Sr | +2 | |||||||||||
| 39 | Y | +1 | +2 | +3 | |||||||||
| 40 | Zr | +1 | +2 | +3 | +4 | ||||||||
| 41 | −1 | Nb | +2 | +3 | +4 | +5 | |||||||
| 42 | −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 43 | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 44 | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| 45 | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| 46 | Pd | +2 | +4 | ||||||||||
| 47 | Ag | +1 | +2 | +3 | |||||||||
| 48 | Cd | +2 | |||||||||||
| 49 | In | +1 | +2 | +3 | |||||||||
| 50 | −4 | Sn | +2 | +4 | |||||||||
| 51 | −3 | Sb | +3 | +5 | |||||||||
| 52 | −2 | Te | +2 | +4 | +5 | +6 | |||||||
| 53 | −1 | I | +1 | +3 | +5 | +7 | |||||||
| 54 | Xe | +2 | +4 | +6 | +8 | ||||||||
| 55 | Cs | +1 | |||||||||||
| 56 | Ba | +2 | |||||||||||
| 57 | La | +2 | +3 | ||||||||||
| 58 | Ce | +2 | +3 | +4 | |||||||||
| 59 | Pr | +2 | +3 | +4 | |||||||||
| 60 | Nd | +2 | +3 | ||||||||||
| 61 | Pm | +3 | |||||||||||
| 62 | Sm | +2 | +3 | ||||||||||
| 63 | Eu | +2 | +3 | ||||||||||
| 64 | Gd | +1 | +2 | +3 | |||||||||
| 65 | Tb | +1 | +3 | +4 | |||||||||
| 66 | Dy | +2 | +3 | ||||||||||
| 67 | Ho | +3 | |||||||||||
| 68 | Er | +3 | |||||||||||
| 69 | Tm | +2 | +3 | ||||||||||
| 70 | Yb | +2 | +3 | ||||||||||
| 71 | Lu | +3 | |||||||||||
| 72 | Hf | +2 | +3 | +4 | |||||||||
| 73 | −1 | Ta | +2 | +3 | +4 | +5 | |||||||
| 74 | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 75 | −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| 76 | −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||
| 77 | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||
| 78 | Pt | +2 | +4 | +5 | +6 | ||||||||
| 79 | −1 | Au | +1 | +2 | +3 | +5 | |||||||
| 80 | Hg | +1 | +2 | +4 | |||||||||
| 81 | Tl | +1 | +3 | ||||||||||
| 82 | −4 | Pb | +2 | +4 | |||||||||
| 83 | −3 | Bi | +3 | +5 | |||||||||
| 84 | −2 | Po | +2 | +4 | +6 | ||||||||
| 85 | −1 | At | +1 | +3 | +5 | ||||||||
| 86 | Rn | +2 | +4 | +6 | |||||||||
| 87 | Fr | +1 | |||||||||||
| 88 | Ra | +2 | |||||||||||
| 89 | Ac | +3 | |||||||||||
| 90 | Th | +2 | +3 | +4 | |||||||||
| 91 | Pa | +3 | +4 | +5 | |||||||||
| 92 | U | +3 | +4 | +5 | +6 | ||||||||
| 93 | Np | +3 | +4 | +5 | +6 | +7 | |||||||
| 94 | Pu | +3 | +4 | +5 | +6 | +7 | |||||||
| 95 | Am | +2 | +3 | +4 | +5 | +6 | |||||||
| 96 | Cm | +3 | +4 | ||||||||||
| 97 | Bk | +3 | +4 | ||||||||||
| 98 | Cf | +2 | +3 | +4 | |||||||||
| 99 | Es | +2 | +3 | ||||||||||
| 100 | Fm | +2 | +3 | ||||||||||
| 101 | Md | +2 | +3 | ||||||||||
| 102 | No | +2 | +3 | ||||||||||
| 103 | Lr | +3 | |||||||||||
| 104 | Rf | +4 | |||||||||||
| 105 | Db | +5 | |||||||||||
| 106 | Sg | +6 | |||||||||||
| 107 | Bh | +7 | |||||||||||
| 108 | Hs | +8 |
Высшая степень окисления элемента соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au+3 (I группа), Cu+2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru.
Степени окисления металлов в соединениях
Степени окисления металлов в соединениях всегда положительные, если же говорить о неметаллах, то их степень окисления зависит от того, с каким атомом он соединён элемент:
- если с атомом неметалла то степень окисления может быть и положительная, и отрицательная. Это зависит от электроотрицательности атомов элементов;
- если с атомом металла, то степень окисления отрицательная.
Отрицательная степень окисления неметаллов
Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный химический элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
Обратите внимание, что степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
Источники:
- Greenwood, Norman N.; Earnshaw, A. Chemistry of the Elements — 2-е изд. — Oxford: Butterworth-Heinemann, 1997
- Green Stable Magnesium(I) Compounds with Mg-Mg Bonds / Jones C.; Stasch A.. — Журнал Science, 2007. — Декабрь (вып. 318 (№ 5857)
- Журнал Science, 1970. — Вып. 3929. — № 168. — С. 362.
- Журнал Journal of the Chemical Society, Chemical Communications, 1975. — С. 760b—761.
- Irving Langmuir The arrangement of electrons in atoms and molecules. — Журнал J. Am. Chem. Soc., 1919. — Вып. 41.