Само слово «атом» впервые упоминалось в трудах философов Древней Греции, и в переводе оно означает «неделимый». Не имея современных приборов, философ Демокрит, используя логику и наблюдательность, пришел к выводу, что любое вещество не может дробиться бесконечно, и в итоге должна остаться какая-то неделимая мельчайшая частица вещества – атом вещества.
И если бы не было атомов, то любое вещество или предмет можно было уничтожить полностью. Демокрит стал основоположником атомистики – целого учения, которое основывалось на понятии об атоме.
- Что такое атом
- Из чего состоит атом
- Определение числа нейтронов
- Строение атомов первых десяти химических элементов таблицы Менделеева
- Правило Хунда
- Что такое изотопы
- Есть ли что-то меньше ядра атома
Что такое атом?
Атом – это наименьшая электронейтральная частица любого химического элемента. Он состоит из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Положительно заряженное ядро – это сердцевина атома. Оно занимает мизерную часть пространства в центре атома, и в нем сосредоточены почти вся масса атома и весь положительный заряд.
Из чего состоит атом?
Составляют ядро атома элементарные частицы – нейтроны и протоны, а по замкнутым орбиталям вокруг атомного ядра движутся электроны.
Что такое нейтрон?
Нейтрон (n) представляет собой элементарную нейтральную частицу, относительная масса которой составляет 1,00866 атомной единицы массы (а.е.м.).
Что такое протон?
Протон (р) представляет собой элементарную частицу, относительная масса которой составляет 1,00728 атомной единицы массы, положительным зарядом +1 и спином 1/2. Протон ( переводится с греческого как основной, первый) относится к барионам. В ядре атома число протонов равно порядковому номеру химического элемента в Периодической системе Д.И. Менделеева.
Что такое электрон?
Электрон ( е–) представляет собой элементарную частицу, масса которой составляет 0,00055 а.е.м.; условный заряд электрона: — 1. Количество электронов в атоме равняется заряду ядра атома (соответствует порядковому номеру химического элемента в Периодической системе Менделеева).
Область пространства вокруг атомного ядра, где с вероятностью более 90% присутствуют электроны, определяет форму электронного облака.
Электронное облако р-электрона по внешнему виду напоминает гантель; на трех р-орбиталях по максимуму могут находиться лишь шесть электронов.
Электронное облако s-электрона представляет собой сферу; на s-энергетическом подуровне максимальное количество электронов, которые могут там находиться – это 2.
Данная запись носит название графическая электронная формула. Она выглядит следующим образом:
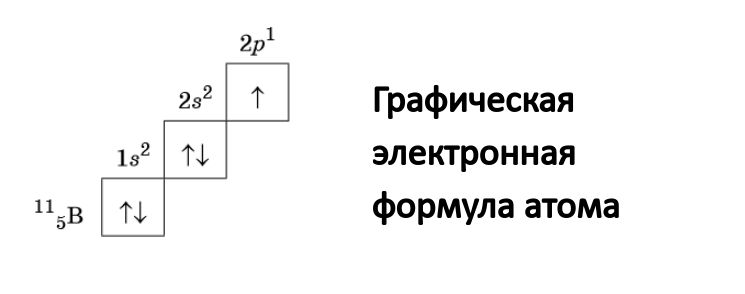
С помощью стрелок в данной формуле обозначают электрон. Направление стрелки соответствует направлению спина – это собственный магнитный момент электрона. Электроны, имеющие противоположные спины (на картинке это направленные в противоположные стороны стрелочки), получили название спаренные.
Электронные конфигурации атомов элементов можно представить в виде формул, в которых:
- Указывают символы подуровня;
- Степень у символа показывает число электронов данного подуровня;
- Коэффициент, стоящий перед символом подуровня обозначает его принадлежность к данному уровню.
Определение числа нейтронов
Для определения числа нейтронов N в ядре нужно воспользоваться формулой:
N=A-Z, где А – массовое число; Z – заряд ядра, который равняется числу протонов (порядковому номеру химического элемента в таблице Менделеева).
Это выглядит так:
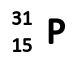
Данная запись обозначает следующее:
- Массовое число равняется 31;
- Заряд ядра (и как следствие, и число протонов) для атома фосфора равняется 15;
- Число нейтронов равно 16. Его высчитывают так: 31-15=16.
Массовое число примерно соответствует относительной атомной массе ядра. Это вызвано тем, что массы нейтрона и протона практически не имеют отличий.
Строение атомов первых десяти химических элементов таблицы Менделеева
Ниже мы представили часть таблицы, в которой приведено строение электронных оболочек атомов первых двадцати элементов Периодической системы химических элементов Д.И. Менделеева. Полная таблица электронных формул атомов представлена в отдельной нашей публикации.

Химические элементы, в атомах которых происходит заполнение р-подуровня, носят название р-элементы. Электронов может быть от 1 до 6.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется 1 или 2 электронами получили название s-элементы.
Число электронных слоев в атоме химического элемента равняется номеру периода.
Правило Хунда
Существует правило Хунда, в соответствии с которым электроны располагаются на однотипных орбиталях одного энергетического уровня так, чтобы совокупный спин был максимально возможным. Это означает, что, когда энергетический подуровень заполняется, каждый электрон сначала занимает отдельную ячейку, и лишь потом запускается процесс их соединения.
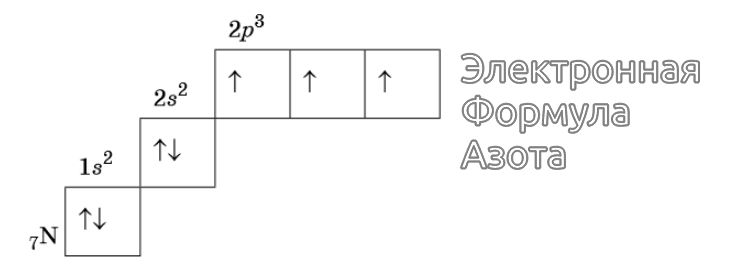
Изображение электронной формулы Азота в графическом виде
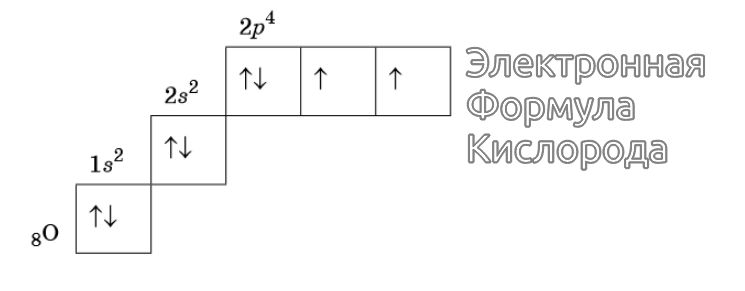
Изображение электронной формулы Кислорода в графическом виде
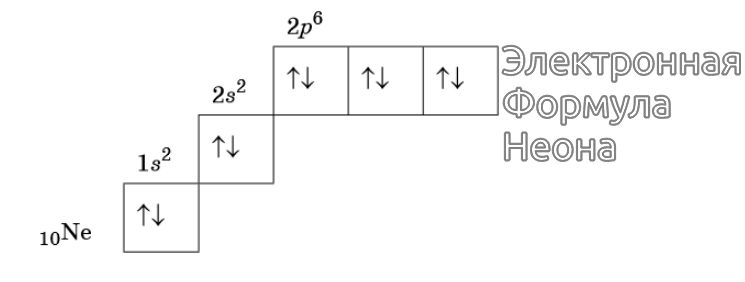
Изображение электронной формулы Неона в графическом виде
К примеру, у атома азота все р-электроны будут занимать отдельные ячейки, а у кислорода начнется их спаривание, которое завершится в полной мере у неона.
Что такое изотопы
Изотопы – это атомы одного и того же элемента, которые в своих ядрах содержат одинаковое количество протонов, но число нейтронов будет различное. Изотопы известны для всех элементов.
По этой причине атомные массы элементов в периодической системе представляют собой среднее значение из массовых чисел природных смесей изотопов и имеют отличия от целочисленных значений.
Есть ли что-то меньше ядра атома
Подведем итоги. Атомная масса природных смесей изотопов не может служить главнейшей характеристикой атома, и, как следствие, и элемента.
Подобной характеристикой атома будет являться заряд ядра, который определяет строение электронной оболочки и количество электронов в ней. Это интересно! Наука не стоит на месте и ученые смогли опровергнуть догму о том, что атом является самой маленькой частицей химических элементов. Сегодня мир знает кварки – из них состоят нейтроны и протоны.



Очень интересная информация, как раз, то что я и искала.